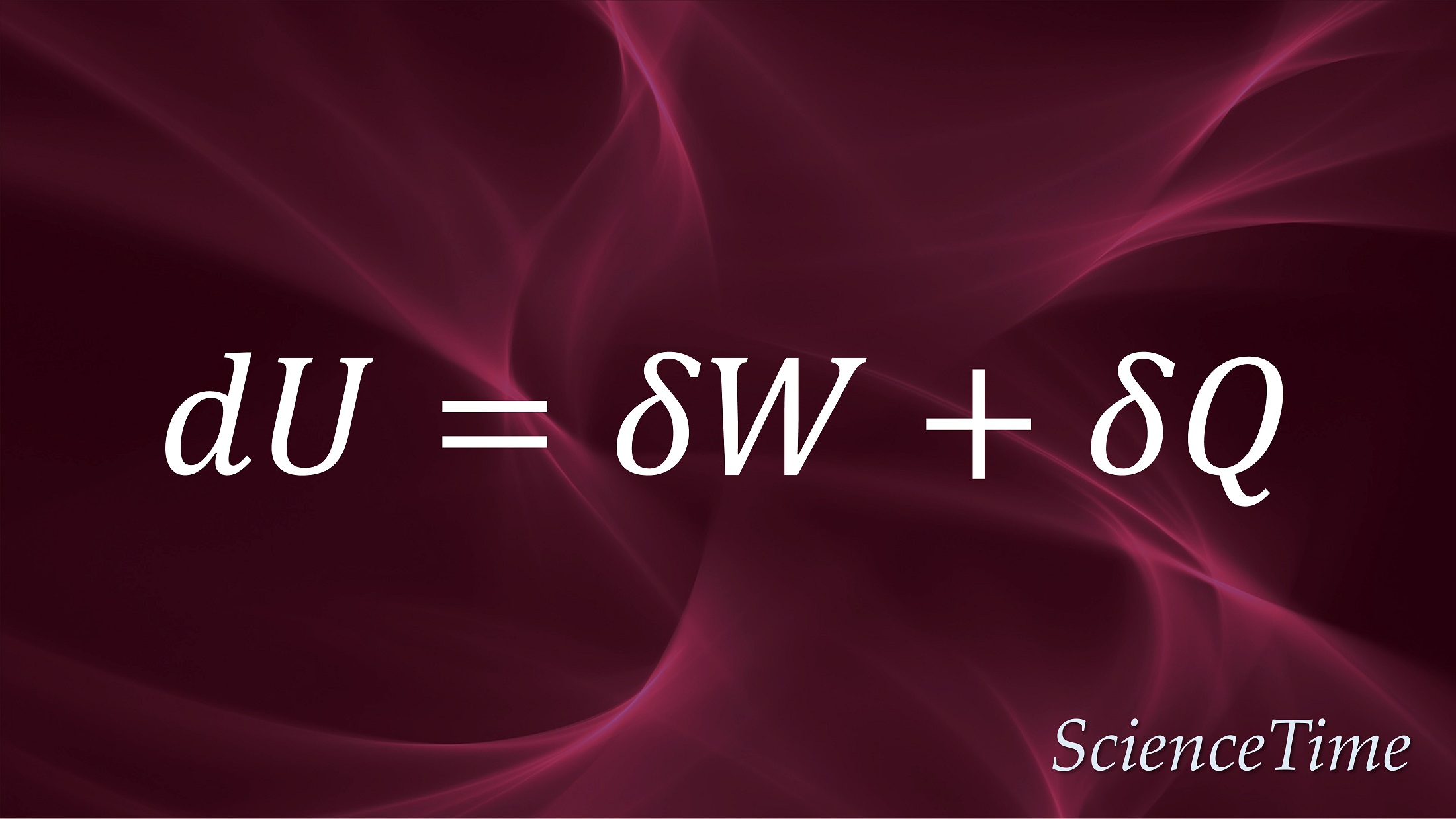Introduction
エネルギーを供給しなくとも仕事をし続ける装置―第一種永久機関(perpetual motion machine of the first kind)と呼ばれる夢の装置―を実現するために,人々はかつて多大な努力を費やした。 しかし,そうした努力が実ることは決してなかった。 その結論として,代わりに人類が到達したのが,熱力学第一法則である。熱力学第一法則は,熱力学的な系が外部と交換するエネルギーは,仕事と熱という二種類の形態をとるが,両者を考慮する限り,エネルギーは保存するということを述べる。 したがって,機械に投入した以上のエネルギーを要求する仕事をさせることはできないのである。
仕事と熱
系として容器に閉じ込められた流体を考える。 圧縮したりかき混ぜたりといった力学的な仕事をすることで,この流体の温度を上昇させることができる。 しかし,力学的な仕事を加えなくとも,対象とする系よりも高温の物体を近づけたり,接触させたりすることによっても温度を上昇させることができる。
例えば,それぞれ温度$T_1,T_2$($T_1\neq T_2$)を持つ物体を接触させると,やがて両物体の温度はともに$T_1$と$T_2$の間の値に落ち着く。 このとき,物体の温度上昇に関して仕事と同様の役割を果たす「何か」---それを熱(heat)と呼ぶ---が,高温の物体から低温の物体へ移動したのだと考えられる。
現在では,熱は乱雑な運動をする分子の運動エネルギーに由来するものであると分っているが,熱力学の基礎が発展させられた19世紀前半の時点では分子運動論は確立されておらず,熱力学は熱の詳細について言及することなく定式化されている。
熱の正体が分からなくとも,経験的に,熱の透過が非常にしづらい,あるいは理想的には一切しない仕切りを構成することができる。 以下,この理想的な仕切りのことを断熱壁(adiabatic wall)と呼ぶ。
断熱仕事と内部エネルギー
断熱壁で囲まれた閉じた系を考える。 このような系であっても,内部に羽根車を通して回転させるとか,電熱線を入れて電流を流すとか,あるいは断熱壁でできたピストンを押し込んで圧縮するとかして,仕事をすることができる。 こうした系を調べることで,ある重要な経験的知識が得られる。
ということである。 ここでいう状態とは,系の圧力$P$と温度$T$で指定されるものとする。 するとこれにより,対応するポテンシャル関数の存在が示唆される(『仕事とエネルギー』参照)。 それを$U$と記せば,すなわち
である。
これは,断熱過程に関するエネルギー保存則を表しており,$i,f$はそれぞれ始状態(initial state)と終状態(final state)を,adは断熱過程(adiabatic process)であることを示している。 右辺の$U$の差は,外部からの仕事によって系内部に得られたエネルギーを表しており,このことから$U$は,内部エネルギー(internal energy)と呼ばれる。
熱と熱力学第一法則
今度は断熱壁ではなく,熱を通す壁---透熱壁(diathermic)---を用いて実験を行ってみると,系に及ぼす仕事と,内部エネルギーの変化分は等しいものではなくなる。 この違いは,断熱壁から透熱壁に取り換えることで生じることから,やはり,仕事とは異なる形態,熱としてのエネルギー移動が起こっていることが示唆される。
そこで,このエネルギーの移動量,熱をより良く捉えるため,次のような系を考察する。 系全体として断熱壁に囲まれているが,内部は透熱壁で2つの部分$A$と$B$に区分けされているとする。 こうした設定の下,系全体の内部エネルギーはそれぞれの部分の内部エネルギー$U_A,U_B$の和
で与えられる。

図1
このとき,部分系$A$に仕事$W$を行うと,全体としては閉じた断熱系であるため,これは系全体の内部エネルギーの変化$\Delta U$と等しくなる。 一方,$\Delta U$は$\Delta U=\Delta U_A+\Delta U_B$と書けるから
あるいは
である。 この$-\Delta U_B$は,部分系$A$から$B$へ仕事以外の形で移動したエネルギーを表しており,これを熱と定義しよう。 すなわち$Q=-\Delta U_B$であり,部分系$A$のエネルギー収支は
と表せる。 ここで$Q$は系に流入する熱量として定義してあり,今の場合は値が負であるから系から流れ出る熱量と理解される。
この関係は,実験的な裏付けを持って一般化され
と書かれる。 すなわち,(\ref{eq:1stlaw})は,保存則(\ref{eq:adW})を熱のやり取りをする操作を含めたものに拡張したものであり,内部エネルギーの変化$\Delta U$は,系になされる仕事$W$および系に流れ込む熱$Q$の和で与えられるということを表している。 この法則を,熱力学第一法則(first law of thermodynamics)という。 無限小の変換については
である。 $dW$や$dQ$ではなく,$\delta W$や$\delta Q$と表記してある理由は,これらが全微分ではなく,一般に経路による量であることを明示するためである。 一方,内部エネルギーの変化は全微分であり,状態の移行に伴う内部エネルギーの変化は経路によらず始状態と終状態で完全に決まる。 したがって,熱力学第一法則の別の表現として
と述べることもできる。
熱と熱力学第一法則
今度は断熱壁ではなく,熱を通す壁―透熱壁(diathermic)―を用いて実験を行ってみると,系に及ぼす仕事と,内部エネルギーの変化分は等しいものではなくなる。 この違いは,断熱壁から透熱壁に取り換えることで生じることから,やはり,仕事とは異なる形態,熱としてのエネルギー移動が起こっていることが示唆される。
そこで,このエネルギーの移動量,熱をより良く捉えるため,次のような系を考察する。 系全体として断熱壁に囲まれているが,内部は透熱壁で2つの部分$A$と$B$に区分けされているとする(図1)。 こうした設定の下,系全体の内部エネルギーはそれぞれの部分の内部エネルギー$U_A,U_B$の和
で与えられる。

図1
このとき,部分系$A$に仕事$W$を行うと,全体としては閉じた断熱系であるため,これは系全体の内部エネルギーの変化$\Delta U$と等しくなる。 一方,$\Delta U$は$\Delta U=\Delta U_A+\Delta U_B$と書けるから
あるいは
である。 この$-\Delta U_B$は,部分系$A$から$B$へ仕事以外の形で移動したエネルギーを表しており,これを熱と定義する。 すなわち$Q=-\Delta U_B$であり,部分系$A$のエネルギー収支は
と表せる。 ここで$Q$は系に流入する熱量として定義してあり,今の場合は値が負であるから系から流れ出る熱量と理解される。
この関係は,実験的な裏付けを持って一般化され
と書かれる。 すなわち,(\ref{eq:1stlaw})は,保存則(\ref{eq:adW})を熱のやり取りをする操作を含めたものに拡張したものであり,内部エネルギーの変化$\Delta U$は,系になされる仕事$W$および系に流れ込む熱$Q$の和で与えられるということを表している。 これを,熱力学第一法則(first law of thermodynamics)という。
無限小の変化については
である。 $dW$や$dQ$ではなく,$\delta W$や$\delta Q$と表記してある理由は,これらが全微分ではなく,一般に経路による量であることを明示するためである。 一方,内部エネルギーの変化は全微分であり,状態の移行に伴う内部エネルギーの変化は経路によらず始状態と終状態で完全に決まる。 したがって,熱力学第一法則の別の表現として
系の状態を様々な方法で変化させるとき,その内訳は様々であるが,系になされる仕事と流入する熱の和は一定である。
と述べることもできる。
References
――アトキンス物理化学〈上〉. 中野 元裕ほか訳. 東京化学同人.
―― (2017). 生物物理学における非平衡の熱力学 (新装版). 青野修 他 訳. みすず書房.